


Next: Fenómenos de transporte
Up: Conceptos de termodinámica
Previous: Hipótesis de equilibrio termodinámico
Índice General
Resumen de algunos conceptos y relaciones
termodinámicas
El primer principio de la termodinámica en un proceso reversible
(proceso quasi-estático sin fricción, en el que el sistema se
mantiene en todo momento en equilibrio con el exterior) puede
expresarse de la forma
donde 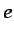 es la energía interna específica (energía interna por
unidad de masa) y
es la energía interna específica (energía interna por
unidad de masa) y 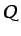 el calor añadido por unidad de masa.
el calor añadido por unidad de masa.
En sistemas de un único componente, el estado termodinámico queda
determinado con la especificación de dos variables de estado
independientes. Así, por ejemplo, conocidas la temperatura y la
presión, pueden determinarse la densidad y la energía interna
específica mediante las dos relaciones siguientes, denominadas
ecuaciones de estado:1.11
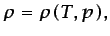 |
(1.11) |
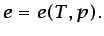 |
(1.12) |
La entalpía específica se define como
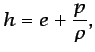 |
(1.13) |
que, como se verá más adelante, es muy útil en el estudio de
flujos compresibles.
En sistemas de un componente, los calores específicos a presión
constante y a volumen constante se definen como sigue:
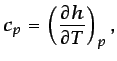 |
(1.14) |
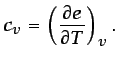 |
(1.15) |
Obsérvese que 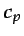 y
y 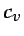 son también variables de estado.
La relación de calores específicos es
son también variables de estado.
La relación de calores específicos es
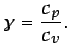 |
(1.16) |
En procesos reversibles,
siendo 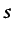 la entropía por unidad de masa. A partir de las
ecuaciones (1.10) y (1.17) se deduce
la entropía por unidad de masa. A partir de las
ecuaciones (1.10) y (1.17) se deduce
y, teniendo en cuenta la ecuación (1.13),
A pesar de que las ecuaciones (1.10) y (1.17) son
aplicables sólo para procesos reversibles, las ecuaciones
(1.18) y (1.19), que expresan relaciones en las
que intervienen exclusivamente variables de estado, son también
válidas en procesos irreversibles.
En gases perfectos, se satisface la siguiente ecuación de estado:
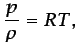 |
(1.20) |
donde 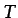 es la temperatura absoluta y
es la temperatura absoluta y 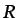 la constante del gas.
La energía interna es independiente de la distancia entre
moléculas y, por tanto, de la densidad:1.12
la constante del gas.
La energía interna es independiente de la distancia entre
moléculas y, por tanto, de la densidad:1.12
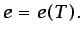 |
(1.21) |
Teniendo en cuenta las ecuaciones (1.13), (1.20) y
(1.21), resulta
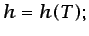 |
(1.22) |
es decir, la entalpía es también sólo función de la temperatura.
De las ecuaciones (1.14) y (1.15), teniendo en cuenta las
ecuaciones (1.21) y (1.22), se deduce que 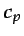 y
y
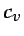 son asimismo sólo funciones de la temperatura, y que
son asimismo sólo funciones de la temperatura, y que
d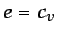 d d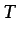 |
(1.23) |
d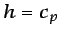 d d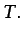 |
(1.24) |
Es inmediato deducir que
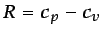 . En gases
caloríficamente perfectos, los calores específicos
. En gases
caloríficamente perfectos, los calores específicos 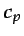 y
y
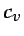 se suponen constantes (lo que puede ser aceptable en
ocasiones, en determinados rangos de temperatura), con lo que
resulta
se suponen constantes (lo que puede ser aceptable en
ocasiones, en determinados rangos de temperatura), con lo que
resulta 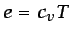 y
y 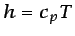 .
.
En líquidos caloríficamente perfectos,
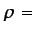 constante constante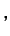 |
(1.25) |
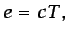 |
(1.26) |
siendo 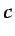 el calor específico, que se supone constante. De la
ecuación (1.18) se deduce que la entropía sólo depende de
la temperatura, y de las ecuaciones (1.14) y (1.15),
el calor específico, que se supone constante. De la
ecuación (1.18) se deduce que la entropía sólo depende de
la temperatura, y de las ecuaciones (1.14) y (1.15),
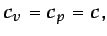 |
(1.27) |
resultando, por tanto, 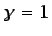 . La entalpía es función de la
temperatura y la presión:
. La entalpía es función de la
temperatura y la presión:
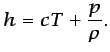 |
(1.28) |
La variación que experimenta la densidad de un líquido real con la
presión y la temperatura puede expresarse como sigue:
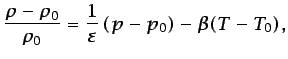 |
(1.29) |
siendo 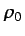 ,
, 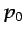 y
y 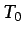 valores de referencia,
valores de referencia,
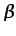 el coeficiente de dilatación térmica, y
el coeficiente de dilatación térmica, y
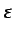 el
módulo de elasticidad del líquido (su inverso es el módulo de
compresibilidad isotermo, que frecuentemente también se denota con
el
módulo de elasticidad del líquido (su inverso es el módulo de
compresibilidad isotermo, que frecuentemente también se denota con
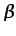 ).
).



Next: Fenómenos de transporte
Up: Conceptos de termodinámica
Previous: Hipótesis de equilibrio termodinámico
Índice General
© 2000, 2001, Julio Hernández Rodríguez, ETSII, Universidad Nacional de Educación a Distancia, Madrid